重症医学科临床科研规范 临床科研的基本要求 在充分保障患者的安全和利益、科室医疗质量和秩序的前提下,合理使用临床资源, 不断提高临床科研的质量和水平, 杜绝单纯重复试验和数据造假现象。
开展临床科研的具体流程 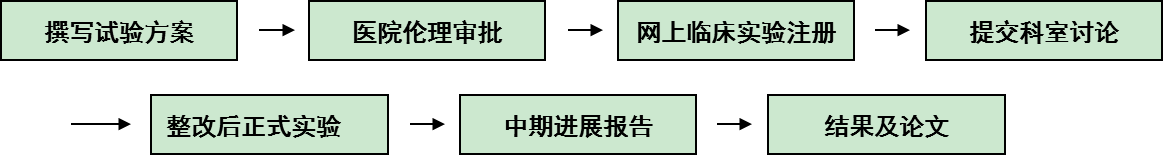
注意事项
(1)科室所有临床科研必须遵循严格临床科研流程,否则不予进行。未遵守流程擅自进行试验者, 试验实施过程中出现任何问题(包括医疗事故、医患纠纷、科研差错等)均由个人承担, 科室概不负责;非本科室的临床试验参与患者转入ICU后,如需要继续进行试验,需向医疗组长出示患者知情同意书并提交在ICU进行的试验计划,获得同意后方可执行。试验时需严格遵守ICU临床操作规范。试验过程中出现问题,可向科研管理小组提出予以协调安排。
(2)试验方案中要求包括计划参与医疗小组,纳入患者人数,试验周期,费用,成果分配方案,患者知情同意书,试验意外时紧急处理措施,试验记录表格。
(3)计划发英文杂志者,需在美国临床试验注册中心上进行注册:www.clinicaltrial.com;计划发中文文章者需在中国临床试验注册中心 进行注册:www.chictr.org,因未进行注册者而影响文章发表,后果自负。
(4)提交科室讨论时需阐述方案,出示伦理和临床试验登记号,讨论意见及整改意见将存档,伦理审批流程请参考以下网站:http://wcums.scu.edu.cn/zxbhs/Content.asp?ID=6。
(5)讨论后需提交方案修改计划,参与试验人员名单、分工以及成果分配方案。讨论时参与试验的医疗组长, 病区护士长, 以及参与试验人员必须出席,医疗组长因故无法参加者需由助理参加,并将讨论结果转达给医疗组长;由护士长指定质量监控人,科研管理小组将在讨论时设定监督员,定期抽查结果。科研小组将统计医疗组长参与临床试验讨论的出席率并纳入年终奖考核。参与试验质量控制者科室将给与一定奖励。
(6)科研方案中需明确科研成果最终分配意向并取得所有参与者同意,需有签字同意书,交由科室存档。若最终成果分配与科研方案不一致时,需提交说明,并取得参与者的同意。
(7)所有数据记录必须做到及时,真实,详细,不得篡改,编造数据。质量监控人将定期抽查病例报告表,发现有伪造数据时,该病例剔除试验;屡教不改者,终止其试验。
(8)病区护士长及科研管理小组成员将不定期抽查病例报告表,若发现质量监控人失职,将取消其署名权及监控资格。
(9)临床科研大于1年,应有中期进展报告,如有试验方案调整,其讨论意见及整改意见应存档。
(10)临床科研结束时,应有结题报告,说明本次科研的成果产出。 | 
